Die üblichen Regeln der Kommunikation neuer Forschungsergebnisse sind in Zeiten des Coronavirus außer Kraft gesetzt: Gestern wurden zum einen positive Resultate einer randomisierten klinischen Studie zu dem Wirkstoff Remdesivir veröffentlicht. Zum anderen wurden zeitgleich negative Ergebnisse einer klinischen Studie derselben Substanz in einer aus Mangel an Patienten vorzeitig abgebrochenen Studie in China im Fachmagazin „The Lancet“ kommuniziert.
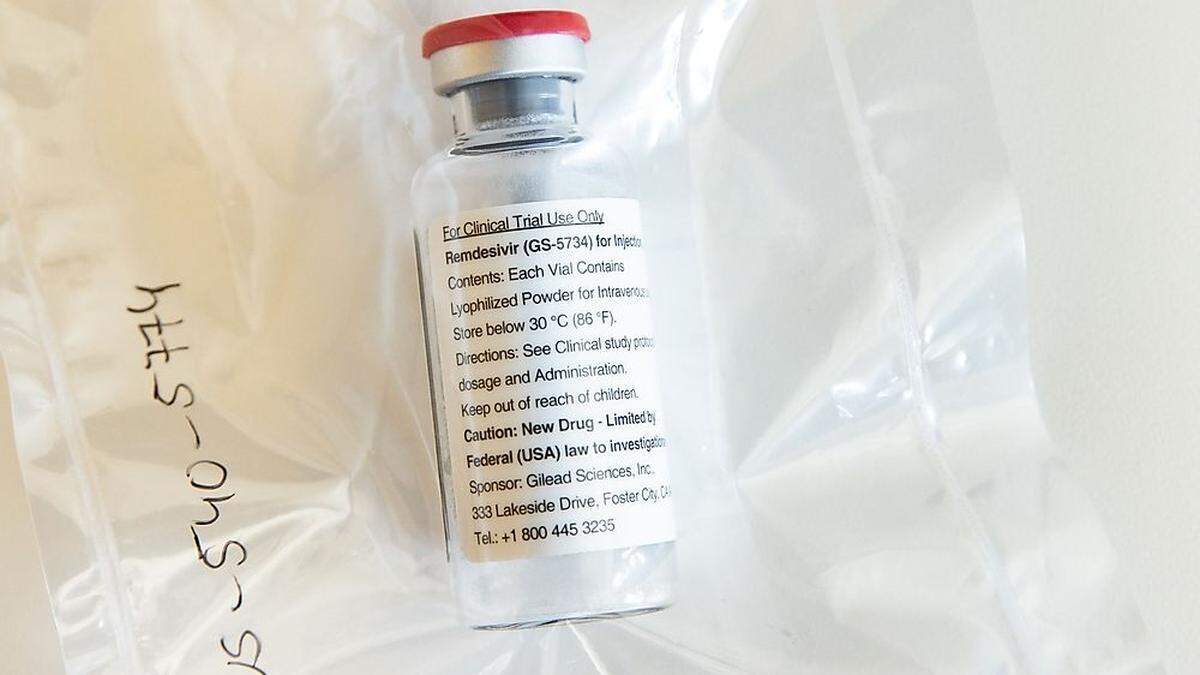
Remdesivir ist ein bisher nicht zugelassenes Medikament, das in den Forschungslabors der Pharmafirma Gilead als GS-5734 entwickelt wurde – als ein Hemmstoff der RNA-abhängigen RNA-Polymerase (RdRp) von Viren wie Ebola und MERS. Die Substanz galt aufgrund früherer Zellkulturversuche und erster Experimente an Makaken als einer der aktuell vielversprechendsten Wirkstoffe gegen SARS-CoV-2 und wurde zuerst in Wuhan in randomisierten klinischen Studien auf seine Wirksamkeit bei schwer an Covid-19 erkrankten Patienten auf Intensivstationen erprobt. Die Wissenschaftler kamen zu negativen Ergebnissen und brachten die Studie vorzeitig ab.
Am gleichen Tag veröffentlichte das US-amerikanische National Institute for Allergy and Infectious Diseases (NIAID) in einer Pressemitteilung erste vorläufige Ergebnisse der Studie "Adaptive Covid-19 Treatment Trial". In dieser randomisiert-kontrollierten Studie sollten insgesamt 1063 Patienten mit unterschiedlichem Schweregrad der Erkrankung zehn Tage lang mit Remdesivir oder Placebo behandelt werden. Bei einer Sitzung des Data Safety Monitoring Boards (DSMB) am 27. April entschied man sich, die Studie vorzeitig abzubrechen. Bei Remdesivir sei der „Zeitpunkt bis zur Genesung“ als primärer Endpunkt der Studie gegenüber Placebo überlegen. Definiert wurde „Genesung“ von den Experten als Entlassung aus dem Krankenhaus oder die Rückkehr zu einem „normalen Aktivitätsniveau“.
Vorläufige Ergebnisse deuteten nun nach Auskunft des NIAID daraufhin, dass Covid-19-Patienten, die Remdesivir erhielten, eine um durchschnittlich 31 Prozent schnellere Genesungszeit aufwiesen als Patienten, die ein Placebo erhielten. Die mediane Zeit bis zur Genesung bei Patienten, die mit Remdesivir behandelt wurden, betrug 11 Tage im Vergleich zu 15 Tagen bei Patienten, die ein Placebo erhielten. Dem DSMB zufolge deuten diese Ergebnisse zugleich auf einen leichten Überlebensvorteil hin. Die Mortalitätsrate betrug in der mit Remdesivir behandelten Gruppe acht verglichen mit 11,6 Prozent im Placeboarm der Studie. Dieser für die Beurteilung wichtige Unterschied erreichte allerdings keine statistische Signifikanz (p=0,059). Der Direktor der NIAID, Anthony Fauci, betonte, dass die Ergebnisse der Studie nun von unabhängigen Experten begutachtet werden müssten.
„Damit konnte zum ersten Mal die Wirksamkeit einer Substanz gegen Covid-19 in einer nach höchsten Standards durchgeführten Studie nachgewiesen werden. Mit einer raschen Zulassung von Remdesivir zur Behandlung von Covid-19 ist deshalb zu rechnen. Für Patienten mit einer schweren Form dieser Erkrankung macht diese Studie Hoffnung, schneller und sicherer von der Infektion genesen zu können", kommentiert Gerd Fätkenheuer, Leiter einer klinischen Prüfung von Remdesivir bei Patienten in Deutschland.
Dennoch blieben noch viele Fragen bis zur vollständigen Veröffentlichung des Endergebnisses offen. "Eine der wichtigsten ist die, ob alle Patienten gleichermaßen von der Behandlung profitieren, oder ob die Wirksamkeit je nach Schweregrad der Erkrankung unterschiedlich ist. Davon wird entscheidend abhängig sein, welchen Patienten das Medikament verabreicht werden sollte. Denn es ist klar absehbar, dass nicht alle Patienten mit Remdesivir behandelt werden können.“ Es werde auf absehbarer Zeit nicht genügend Impfstoff zur Verfügung stehen. "Es wird deshalb auch dringend erforderlich sein, weitere Wirkstoffe in klinischen Studien zu untersuchen. Der Maßstab für deren Wirksamkeit wird in Zukunft allerdings Remdesivir sein.“